Benvenuti al Carnevale della Chimica n.34!
Il tema di questa edizione è, come sempre avviene nei Carnevali ospitati su Scienza e Musica, ampio e ricco di sfaccettature: "Atomi, ioni e particelle".
Prima di osservare la sfilata dei meravigliosi contributi arrivati, come tradizione, il Carnevale si apre con una corposa introduzione sul tema prescelto.
This is the beginning!
La parola "atomo" deriva dall'aggettivo greco àtomos, ovvero "indivisibile", "privo di parti".
Il concetto di atomo è davvero molto antico: diversi filosofi greci avevano infatti congetturato l'esistenza di un mattone fondamentale della natura, il quale risultasse appunto indivisibile.
Il fondatore, nel V secolo a.C., della scuola atomistica fu Leucippo di Mileto, nome tuttavia poco noto al grande pubblico, in quanto completamente oscurato da quello del suo allievo Democrito di Abdera (460 a.C. - 370 a.C.).
Democrito, con le sue idee, riuscì in un certo senso a fondere insieme le 2 grandi scuole di pensiero che sussistevano all'epoca: la visione di Eraclito e quella di Parmenide.
Per Eraclito di Efeso (535 a.C. - 475 a.C.) nel mondo non esiste nulla che stia fermo: tutto quanto è in incessante movimento.
Non a caso egli viene particolarmente ricordato per il motto pánta rhêi, ossia "tutto scorre".
Secondo tale singolare prospettiva, non sarebbe possibile bagnarsi 2 volte nel medesimo fiume, giacché le sue acque si rinnovano in modo continuo.
L'antitesi di Eraclito fu appunto Parmenide di Elea, assieme alla sua concezione dell'Essere che "è e non può non essere".
Sì, detto così sembra proprio uno scioglilingua!
In pratica, quello che Parmenide intendeva dire è che esiste solamente un qualcosa denominato "Essere", il quale possiede determinate peculiarità:
- è eterno;
- è finito;
- è ingenerato e imperituro;
- è immutabile e immobile.
Democrito riuscì ad unificare 2 visioni filosofiche così discordanti proprio mediante il concetto di atomo.
Infatti, a detta del filosofo, anche se un oggetto appare immobile e statico, la sua struttura "intima" è costituita da atomi, intervallati dal vuoto, i quali si muovono senza sosta.
La teoria degli atomi ebbe anche molti critici, tra cui Aristotele, il quale sosteneva fermamente che la materia potesse essere suddivisa all'infinito in particelle sempre più piccole ed uguali fra loro.
L'idea dell'atomo venne ripresa anche in epoca latina, in particolare da Epicuro (341 a.C. - 271 a.C.).
Per Epicuro e i suoi discepoli nulla si generava dal nulla, e per le cose non c'era né inizio né fine.
Il movimento degli atomi nel vuoto risultava soggetto soltanto al caso e alla necessità.
Il caso rappresentava il risultato delle leggi meccaniche che regolavano le traiettorie degli atomi, i quali potevano muoversi in qualsivoglia direzione.
La necessità designava invece la conseguenza della loro tendenza naturale a compiere bruschi spostamenti nel procedere in linea retta, il che generava un movimento caotico.
Epicuro ebbe un importante discepolo nel poeta Lucrezio, che, nel suo poema epico-didascalico De rerum natura, fornì un'approfondita descrizione della teoria atomica, tanto che il primo dei 6 libri che compongono la maestosa opera ha come sottotitolo "Gli atomi".
Riporto un significativo frammento, tratto appunto dal libro I:
"Tra i corpi, alcuni sono semplici e altri composti. I corpi semplici, o "atomi", sono indistruttibili proprio per la loro semplicità: essi resistono a ogni forza che cerchi di scomporli, non essendo composti. Però, è difficile credere all'esistenza di cose indecomponibili. Infatti, i mattoni dei muri sono permeabili ai fulmini celesti e alle voci umani. Il fuoco permea e arroventa il ferro, spezza le pietre, scioglie il duro oro e fonde il gelido bronzo. Una coppa d'argento si scalda e si raffredda, tenuta in mano o riempita di vino fresco. Sembra dunque che al mondo non ci sia niente di semplice, ma la ragione e la natura delle cose ci diranno altrimenti. Presta dunque molta attenzione ai prossimi argomenti, nei quali ti dimostro l'esistenza degli atomi, le loro proprietà, e il modo in cui essi costituiscono tutte le cose del mondo. Anzitutto, abbiamo visto che la materia è diversa dal vuoto: le loro nature sono distinte e separate, perché dove c'è materia non c'è vuoto, e dove c'è vuoto non c'è materia. I corpi semplici devono dunque essere materiali e privi di vuoto. I corpi composti, invece, contengono del vuoto circondato da materia. Se non ci fosse del vuoto, tutto sarebbe materia. E se non ci fosse materia, tutto sarebbe vuoto. Ma poiché non ci sono né il pieno assoluto, né il vuoto assoluto, devono esserci atomi capaci di aggregarsi per delimitare il vuoto. E questi atomi sono indistruttibili, perché si può distruggere solo ciò che contiene del vuoto. Anzi, quanto più vuoto contiene un corpo, tanto più è distruttibile, e vulnerabile alle cause della distruzione.
Gli atomi, invece, che non contengono vuoto, non sono composti, e non possono né essere divisi, né soccombere a elementi distruttori come l'acqua o il fuoco: dunque, sono eterni. D'altronde, se la materia passata non fosse stata eterna, nel corso infinito del tempo sarebbe stata completamente distrutta, e la materia presente avrebbe dovuto essere ricreata dal nulla. Ma abbiamo già stabilito che nulla si crea, e nulla si distrugge. Dunque, gli atomi devono essere immortali, per permettere il farsi e disfarsi delle cose."
Lucrezio, come avete potuto constatare dal passo appena riportato, asseriva che i corpi fossero aggregati di atomi separati dal vuoto.
Specificava inoltre che più vuoto essi contengono, più sono leggeri e distruttibili.
Tale teoria venne ripresa, nel 1704, nientemeno che da Isaac Newton (1642-1727).
Costui, nella sua opera Ottica e, in particolare, nella Proposizione II,8, si pose il problema di determinare la quantità di vuoto presente in un corpo, riscontrando che se a ciascun livello di aggregazione le parti che si aggregano occupano uno spazio pari a quello del vuoto che le separa, allora la quantità di vuoto cresce in modo esponenziale rispetto al numero dei livelli.
Nello specifico, al primo è pari a 1/2, al secondo 3/4, al terzo 7/8, al quarto 15/16 e così via.
In altri termini, più la struttura gerarchica di un corpo risulta stratificata, maggiore è il vuoto che essa contiene.
Newton capì dunque che "la causa della riflessione non è che le particelle di luce rimbalzano sulle parti solide dei corpi", in quanto essi contengono molto più vuoto di quanto si potesse immaginare.
Nei primi anni del XX secolo, a Manchester, il fisico e chimico neozelandese Ernest Rutherford (premio Nobel per la Chimica nel 1908) compì diversi esperimenti per sbrogliare una volta per tutte questa intricata questione e capire quanto vuoto contenesse un atomo.
La questione è ben sottolineata da un aneddoto (riportato in Rutherford, Simple Genius di David Wilson), raccontato dallo stesso Rutherford, riguardo delle giornate del 1909 che avrebbero cambiato la storia della scienza:
"Un giorno Geiger venne da me e mi chiese: “Non pensi sia ora che il giovane Marsden cominci a seguire un suo piccolo progetto di ricerca?”. Be'...anch'io ci avevo pensato, risposi. “Perché non gli facciamo verificare se qualche particella alfa può subire deflessioni a grandi angoli?”. 2 o 3 giorni dopo Geiger tornò da me in uno stato di grande agitazione: “Siamo riusciti ad acciuffare alcune delle particelle alfa mentre rimbalzano indietro!"...È stata la cosa più sbalorditiva che mi sia mai capitata. Era incredibile, più o meno come sparare un proiettile calibro 381 contro un foglio di carta velina, vederselo tornare indietro e poi esserne colpito."
Né Rutherford né Geiger avevano compreso pienamente cosa fosse successo nel seminterrato, in quel fatidico giorno del 1909.
L'incredibile evento fu l'apice di una serie di esperimenti sullo scattering delle particelle alfa.
In parole semplici, lo scattering (detto anche diffusione) altro non è che un fenomeno in cui onde oppure particelle vengono deviate a causa di un urto con altre particelle o onde, un po' come succede alle palle da biliardo.
Che cos'è invece una particella alfa?
Era una domanda che assillava Rutherford dopo che aveva scoperto che i raggi alfa erano particelle dotate di carica positiva che venivano deflesse da intensi campi magnetici.
Il fisico neozelandese riteneva che una particella alfa fosse uno ione di elio, ovvero un atomo di elio che aveva perso 2 elettroni, ma, fino a quei fondamentali esperimenti assieme al giovane Hans Geiger, non aveva trovato delle prove concrete che confermassero la sua teoria.
La svolta in tal senso avvenne nell'estate del 1908, periodo in cui i 2 scienziati confermarono che una particella alfa fosse effettivamente un atomo di elio che aveva perduto 2 elettroni, ossia, in simboli, 4He2+.
E furono proprio le particelle alfa ad aiutare Rutherford nell'investigazione della struttura dell'atomo.
"La diffusione è il diavolo" aveva asserito il fisico mentre cercava di smascherare, insieme a Geiger, la particella alfa.
Lo scienziato aveva osservato per la prima volta il particolare fenomeno di scattering 2 anni prima a Montreal, quando alcune particelle alfa che avevano attraversato un foglio di mica erano state lievemente deflesse dalla loro traiettoria rettilinea, producendo una sfocatura su una lastra fotografica.
Rutherford era fermamente deciso ad approfondire la questione ed ebbe l'occasione giusta a Manchester.
Egli, una volta giunto a Manchester, aveva infatti stilato una lista di potenziali argomenti di ricerca e affidò appunto a Geiger il compito di indagare sulla diffusione delle particelle alfa.
I 2 scienziati progettarono assieme un semplice esperimento atto a misurare le scintillazioni, ossia i minuscoli lampi di luce prodotti dalle particelle alfa quando colpivano uno schermo di carta rivestito di solfuro di zinco (ZnS), dopo aver attraversato un sottile foglio d'oro.
Tuttavia, il conteggio delle scintillazioni era tutt'altro che semplice, un lavoro in cui risultava necessario trascorrere ore ed ore nel buio totale.
Ma, a detta di Rutherford, Geiger era "bravissimo in quel lavoro e riusciva a contare con qualche interruzione per una notte intera senza che la sua equanimità ne risentisse".
Questi grandi sforzi servirono per scoprire che le particelle alfa o passavano indisturbate attraverso il foglio d'oro, oppure venivano deflesse di uno o due gradi.
Era ciò che ci si aspettava, nessuna particolare sorpresa, almeno finché Geiger non riferì di aver osservato anche qualche particella alfa "deflessa di un angolo decisamente apprezzabile".
Ci stiamo ancora riferendo al 1908, anno in cui Rutherford, come già detto, venne insignito del Nobel per la Chimica per le sue scoperte inerenti alla radioattività.
Tornato vittorioso da Stoccolma, Rutherford non dormì sugli allori, ma anzi, si mise a studiare come valutare le probabilità associate con differenti gradi di diffusione delle particelle alfa.
I suo calcoli evidenziarono che sussisteva una probabilità minima, quasi nulla, che una particella alfa passando attraverso un foglio d'oro subisse diffusioni multiple aventi come risultato globale una deflessione a grandi angoli.
Quella appena raccontata è la premessa al sensazionale episodio che avvenne nel 1909, quando il giovane Ernest Marsden venne incaricato di verificare se le particelle alfa potessero essere diffuse a grandi angoli, con sorprendente risposta affermativa!
Infatti, anche se la ricerca continuava ad angoli sempre maggiori, a dispetto delle previsioni, Mardsen rinvenne sempre quei lampi di luce che segnalavano la collisione di particelle alfa con lo schermo di solfuro di zinco e trovò persino particelle che rimbalzavano all'indietro contro il foglio d'oro.
A seguito di questa incredibile scoperta, Geiger e Mardsen cominciarono ad effettuare misurazioni comparative servendosi di metalli diversi, rinvenendo che l'oro diffondeva all'indietro quasi il doppio di particelle alfa rispetto all'argento, e 20 volte più dell'alluminio.
Quando poi presero come riferimento il platino, trovarono che solamente una particella ogni 8000 rimbalzava contro un foglio di platino!
Nel momento della pubblicazione, datata giugno 1909, di questi e altri risultati, Geiger e Mardsen si limitarono a descrivere gli esperimenti ed esporre i fatti senza aggiungere alcun commento.
Intanto, Rutherford, per i successivi 18 mesi, ragionò instancabilmente sullo strano fenomeno, cercando di trovarne la causa.
Fu così che, nel 1911, nacque il modello atomico di Rutherford.
Ciò che scoprirono Rutherford, Geiger e Mardsen fece capire che l'atomo non è una cosa indivisibile come immaginavano Democrito, Epicuro e Lucrezio, bensì con all'interno qualcosa di ancor più elementare, un qualcosa in grado di far tornare indietro i "proiettili" rappresentati dalle particelle alfa.
Lucrezio affermava che l'atomo non fosse vuoto, ma si sbagliava.
Fu infatti dimostrato che oltre il 99,99% del volume di un atomo risulta effettivamente costituito da vuoto, ma per una piccolissima percentuale esso è composto da un qualcosa, da delle particelle.
Non deve stupire allora la nascita dei modelli atomici, tra cui appunto quello di Rutherford, modelli che cercarono di spiegare come l'atomo risultasse composto.
A dir la verità, il modello di Rutherford non fu certo il primo ad essere presentato.
Nel 1904, Joseph John Thomson presentò un modello di atomo in cui esso veniva considerato alla stregua di una sfera di carica positiva priva di massa dove risultavano immersi, come uvette in un panettone, gli elettroni carichi negativamente, minuscole particelle proprio da lui scoperte nel 1897.
La carica positiva avrebbe neutralizzato le forze repulsive agenti tra gli elettroni, le quali avrebbero altrimenti frantumato l'atomo.
Per ogni singolo elemento, Thomson immaginava gli elettroni disposti in una serie di anelli concentrici e riteneva che erano il diverso numero e la diversa distribuzione degli elettroni negli atomi, ad esempio d'oro e di piombo, a distinguere i metalli l'uno dall'altro.
Questo modello diventò noto come modello "a panettone" e venne confutato proprio dagli esperimenti di Geiger e Mardsen del 1909.
Infatti, se il modello "a panettone" di Thomson fosse stato corretto, allora le particelle alfa dell'esperimento prima illustrato avrebbero dovuto subire al massimo piccole deflessioni e questo non accadde.
Attenzione dunque a regalare per le feste natalizie un panettone a un fisico o a un chimico: potrebbe scambiarlo per un modello zuccheroso e primitivo di atomo. ;)
Dal faceto ritorniamo al serio dicendo che Rutherford capì dai risultati degli esperimenti che l'atomo doveva contenere al suo interno un nucleo capace di respingere le particelle alfa all'indietro.
Nel dicembre 1910 Rutherford annunciò trionfalmente a Geiger: "Adesso so come è fatto l'atomo!".
Rutherford aveva infatti ideato un modello atomico in cui vi era un piccolissimo nocciolo centrale dotato di carica positiva, il nucleo, il quale conteneva all'incirca tutta la massa dell'atomo.
Attorno ad esso circolavano, come i pianeti intorno al Sistema Solare, i piccoli elettroni di carica negativa.
Con questa idea di atomo i risultati dell'esperimento con le particelle alfa trovarono finalmente una giustificazione.
In ogni collisione la maggior parte delle particelle alfa attraversava in linea retta l'atomo, poiché passava troppo lontano dal minuscolo nucleo per subire una qualsivoglia deflessione.
Altre particelle deviavano leggermente dalla loro traiettoria, in quanto incontravano il campo elettrico generato dal nucleo, subendo pertanto una leggera deflessione.
Più le particelle passavano vicino al nucleo, maggiore risultava l'effetto del campo elettrico e di conseguenza la deflessione rispetto alla traiettoria originaria.
E poi c'era il caso limite, raro, ovvero quando una particella si avvicinava al nucleo frontalmente.
Nel suddetto caso, la forza repulsiva agente (ricordiamo che anche le particelle alfa hanno carica positiva) tra le 2 cariche la faceva ritornare all'indietro, come se lanciassimo una palla contro un muro solido.
Il 7 marzo 1911 Rutherford diede comunicazione del suo modello atomico in una memoria presentata a una riunione della Società letteraria e filosofica di Manchester.
4 giorni dopo Rutherford ricevette dal fisico e chimico William Henry Bragg una lettera, la quale voleva informarlo che circa 5-6 anni prima il fisico giapponese Hantaro Nagaoka aveva sviluppato un modello atomico con "un grosso centro positivo".
Ma Bragg era all'oscuro del fatto che Nagaoka era stato in visita da Rutherford l'estate precedente.
All'incirca 2 settimane dopo l'epistola di Bragg, Rutherford ne ricevette un'altra da parte dello stesso Nagaoka, il quale gli aveva scritto per esprimere la sua gratitudine per la gentilezza che aveva avuto nei suoi riguardi a Manchester e sottolineando di aver proposto nel 1904 un modello "saturniano" dell'atomo, il quale considerava l'atomo come un grosso centro pesante circondato da anelli rotanti di elettroni, similmente al bellissimo pianeta Saturno con i suoi caratteristici anelli.
Pur essendo simili, sussistevano comunque significative differenze tra il modello rutherfordiano e quello di Nagaoka.
In quello di Nagaoka il corpo centrale dotato di carica positiva era pesante e occupava grossa parte dell'atomo, piatto come una frittella, mentre il modello sferico di Rutherford presupponeva un nucleo assai piccolo e un atomo pressoché vuoto.
Comunque, per quanto il modello atomico "planetario" di Rutherford risultasse migliore di quello "a panettone" e di quello "saturniano", anch'esso non era immune da grossi difetti, che non potevano venire ignorati.
Infatti, secondo la fisica classica, l'elettrone sarebbe dovuto cadere nel nucleo e Rutherford non era riuscito a spiegare il perché ciò non accadesse!
Nello specifico, il modello di Rutherford soffriva di un'instabilità di carattere sia elettromagnetico che meccanico.
L'elettrodinamica classica stabilisce che quando una particella accelera, essa rilascia energia sotto forma di onde elettromagnetiche.
Dunque, siccome l'elettrone, nel suo girare intorno al nucleo positivo, è sottoposto a un'accelerazione, esso irraggia energia elettromagnetica della stessa frequenza del proprio moto di rivoluzione, il che comporta una perdita della sua energia e la sua caduta sul nucleo con un moto a spirale.
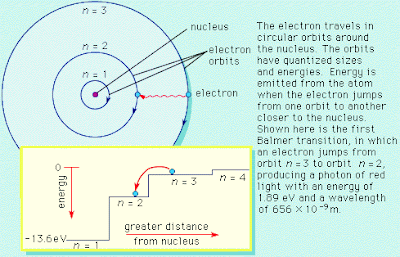
A risolvere il non semplice problema ci pensò il fisico danese Niels Bohr, che propose nel 1913 il suo famoso modello quantistico di atomo.
I dettagli del modello di Bohr li ho già descritti qui.
Mi limiterò dunque a riportare una magnifica immagine riassuntiva del suddetto modello:
Successivamente si chiarì la composizione del nucleo atomico.
Esso risulta composto da 2 tipologie diverse di particelle, i protoni e i neutroni.
I protoni vennero scoperti da Eugene Goldstein nel 1886, nei suoi esperimenti con i tubi a raggi catodici, con catodo forato.
La denominazione "protone" a questa particella dotata di carica positiva gli venne però attribuita soltanto decenni dopo da Rutherford.
La scoperta del neutrone, che, come dice il nome stesso, non possiede carica elettrica, venne invece effettuata nel 1932 da Sir James Chadwick.
Come ha scritto il chimico William H. Cropper nel suo libro intitolato Great Physicists:
"La strada verso la scoperta dei neutroni da parte di James Chadwick è stata lunga e tortuosa. Poiché non sono portatori di carica elettrica, i neutroni non lasciano una scia osservabile di ioni mentre attraversano la materia e nemmeno tracce nella camera a nebbia di Wilson; per lo sperimentatore praticamente erano come invisibili."
Il neutrone venne infatti scoperto solamente grazie alla ricerca instancabile di Chadwick e non per puro caso come la radioattività e i raggi X.
Nel 1931 Irène Joliot-Curie (figlia della celebre Marie, vincitrice di 2 premi Nobel, uno per la Fisica, uno per la Chimica) e il marito Frédéric Joliot riscontrarono nei loro esperimenti una misteriosa radiazione, prodotta dal bombardamento di atomi di berillio con particelle alfa, radiazione capace di strappare i protoni da paraffina contenente idrogeno.
L'anno seguente Chadwick effettuò ulteriori esperimenti e suggerì che questa singolare radiazione fosse composta da particelle neutre di massa approssimativamente pari a quella dei protoni, i neutroni appunto.
Spingendoci all'interno del sistema periodico degli elementi (atomi che sono caratterizzati dallo stesso numero atomico, cioè da un identico numero di protoni o, analogamente, di elettroni), i neutroni sono quelle particelle che "cambiano le carte in tavola" in questo sistema, perché sono loro i responsabili dell'esistenza degli isotopi.
Gli isotopi sono quegli atomi che presentano lo stesso numero atomico, ma differente numero di massa (il numero di massa, ricordiamo, è la somma di protoni e neutroni) e questo differente numero di massa è provocato unicamente dai neutroni, visto che il numero di protoni rimane sempre costante.
Il termine "isotopo" venne suggerito al radiochimico inglese Frederick Soddy nel 1913 da Margaret Todd, una sua lontana parente scozzese.
Conversando con lei, Soddy stava cercando di illustrarle che le sue ricerche sembravano mostrare che diversi elementi occupassero lo stesso posto del sistema periodico.
La Todd, donna saggia e colta, subito notò che in greco lo "stesso posto" si dice iso-tópos e gli consigliò di utilizzare tale parola.
Soddy accettò ben volentieri il suggerimento e il termine "isotopo" divenne di uso comune.
La scoperta degli isotopi gli valsero inoltre il premio Nobel per la Chimica nel 1921.
Finora abbiamo parlato di atomi e abbiamo anche visto le particelle che li compongono (protoni e neutroni, a dir la verità, sono composti a loro volta da particelle ancora più piccole dette quark).
Non abbiamo però ancora "toccato" in modo netto la terza parola chiave di questa edizione del Carnevale: "ioni".
Gli ioni sono semplicemente atomi o molecole che non risultano elettricamente neutri, in altre parole possiedono una carica elettrica positiva oppure negativa.
Un atomo può infatti guadagnare o perdere uno o più elettroni in un processo chiamato ionizzazione.
Se un atomo neutro cede uno o più elettroni ad altri atomi, allora il suo numero di elettroni diviene ovviamente inferiore a quello dei protoni.
Ergo, l'atomo diventa uno ione carico positivamente chiamato catione.
Il caso antitetico è quello in cui un atomo acquista uno o più elettroni, con la conseguenza che il numero di elettroni diventa maggiore di quello dei protoni e si ha uno ione carico negativamente, l'anione.
 |
| Cationi (in alto) e anioni (in basso) |
Ma come si può prevedere se un atomo di un elemento formerà preferenzialmente un anione o un catione?
In generale, il risultato dipende dal fatto che l'elemento sia un metallo oppure un non metallo.
Durante le reazioni chimiche, i metalli, generalmente, cedono elettroni generando cationi, mentre i non metalli acquistano elettroni, dando vita ad anioni.
Gli ioni si possono distinguere in 2 categorie:
1) monoatomici;
2) poliatomici.
Gli ioni monoatomici derivano da singoli atomi che hanno ceduto o acquistato elettroni.
Per esempio, prendiamo come riferimento un atomo di sodio (Na).
Il sodio occupa la posizione n.11 all'interno della tavola periodica.
Dunque esso possiede 11 elettroni, 2 sistemati nel primo livello di energia, 8 nel secondo e 1 nell'ultimo livello.
 |
| Configurazione elettronica del sodio |
Quest'ultimo è un elettrone di valenza, appunto un elettrone situato nell'ultimo guscio elettronico di un atomo.
Siccome la configurazione più stabile per un atomo è il famoso ottetto, ossia il possedere 8 elettroni sull'ultimo livello di energia, il sodio tende a cedere il suo elettrone extra, trasformandosi dunque in un catione:
Na → Na+ + e−
Gli ioni poliatomici sono invece formati da 2 o più atomi e l'insieme possiede una carica elettrica.
Per fare un esempio, citiamo lo ione carbonato, CO32-, un comune anione poliatomico.
Lo ione ha 2 cariche negative in quanto possiede 2 elettroni in eccesso (per un totale di 32) rispetto al numero di protoni (30) presenti nei nuclei di un atomo di carbonio (6 protoni) e di 3 atomi di ossigeno (8 × 3 = 24 protoni).
Concludiamo dicendo che uno dei legami chimici fondamentali è nientemeno che il legame ionico.
Il legame ionico è un legame di natura elettrostatica che avviene quando si combinano tra loro 2 atomi aventi una notevole differenza di elettronegatività.
Che significa?
L'elettronegatività è la misura della capacità di un atomo di attrarre su di sé elettroni quando partecipa a un legame chimico.
Tale concetto venne introdotto dal premio Nobel per la Chimica Linus Carl Pauling nel 1932.
L'elettronegatività è una proprietà periodica: essa cresce da sinistra a destra lungo un periodo (cioè una riga) della tavola periodica e diminuisce dall'alto in basso lungo un gruppo (ovvero una colonna), come mostra la seguente immagine:
Pertanto un legame ionico si verifica tra un atomo fortemente elettronegativo e uno poco elettronegativo (o, in altri termini, fortemente elettropositivo).
In particolare, per avere un legame ionico, i 2 atomi devono presentare una differenza di elettronegatività (che indichiamo con Δχ) superiore, in valore assoluto, a uno specifico valore e questo valore è Δχ = 1,7.
Citando Wikipedia:
"Nel legame ionico l’attrazione esercitata dal nucleo dell’atomo più elettronegativo sull’altro atomo, meno elettronegativo, è così forte che la nuvola di carica elettronica può considerarsi come spostata completamente sull’elemento più elettronegativo. L’elettrone dell’altro elemento, meno elettronegativo, viene strappato e un legame ionico è creato in seguito alla formazione di un catione e un anione. Il legame così creato è puramente elettrostatico dovuto all’attrazione reciproca (per la legge di Coulomb) dai due ioni di carica opposta."
Tutti i giorni abbiamo a che fare con una molecola che si forma proprio grazie a un legame ionico: il cloruro di sodio, NaCl (il sale da cucina in pratica).
L'immagine che segue illustra in maniera perfetta come si genera il sale che usiamo per insaporire le pietanze:
Tale immagine si può ben trasfigurare in un simpatico dialogo immaginario tra sodio e cloro.
Sodio: "Amico mio, ho un grosso problema e tu puoi darmi una mano. C'è questo minchia di elettrone in più che mi fa star male. Non ce la faccio più, me ne devo liberare. Ho bisogno di raggiungere quel dannato stato di ottetto. Ti propongo un accordo conveniente per entrambi, una proposta che non potrai rifiutare. Ascoltami bene. Ho intenzione di regalarlo a te, che, peraltro, necessiti proprio un elettrone per completare l'ottetto. In cambio non voglio assolutamente nulla. Allora, accordo raggiunto?"
Cloro: "Proposta assai conveniente! Accetto volentieri. È il miglior regalo di Natale che potessi ricevere."
C'è però da dire che il sistema ione positivo e ione negativo non raggiunge il massimo di stabilità con la formazione di una singola coppia di ioni, bensì nella formazione del solido cristallino in cui ogni ione attrae il maggior numero possibile di ioni di segno opposto e diviene minima la repulsione tra ioni dello stesso segno.
Nel caso del cloruro di sodio cristallino ciascun ione positivo ha come primi vicini, a distanza uguale, 6 ioni negativi, e viceversa.
È recente la scoperta di legami chimici che interessano non solo gli elettroni più esterni, come sempre si è pensato, ma anche quelli dei gusci più interni.
Tutto ciò è stato dimostrato da Mao-sheng Miao, chimico dell'Università della California Santa Barbara e del Beijing Computational Science Research Center, in Cina.
Miao è riuscito a prevedere l'esistenza (che dovrà essere confermata per via sperimentale) di tali particolarissimi legami tramite una serie di simulazioni del comportamento di atomi di cesio e fluoro.
I dettagli di questa notizia li potete trovare qui.
Direi che è giunto il momento di fermarci con l'introduzione, lunga sì, ma di certo non esaustiva, visti gli argomenti così importanti e vasti.
Come ciliegina sulla torta di questa introduzione, ecco dei magnifici video sugli ioni e il legame ionico:
E adesso arriva il momento clou dell'evento: la sfilata degli splendidi contributi che i nostri carnevalisti hanno prodotto per questa kermesse.
Essi sono stati suddivisi in 2 sezioni e al termine di ciascuna troverete un po' di musica (natalizia), elemento che non può mancare in un Carnevale ospitato su questo blog.
Bando alle ciance!
ATOMI, IONI E PARTICELLE:
 Apriamo le danze con un contributo che definire poliedrico sarebbe un eufemismo. Trattasi di un post di Marco Fulvio Barozzi dal suo mitico blog Popinga (che dovreste ben conoscere) e intitolato "Thomas Hariot e il circolo degli atomisti inglesi", un'immersione nella biografia e nei contributi del suddetto matematico e astronomo, con particolare riferimento alla teoria atomica.
Apriamo le danze con un contributo che definire poliedrico sarebbe un eufemismo. Trattasi di un post di Marco Fulvio Barozzi dal suo mitico blog Popinga (che dovreste ben conoscere) e intitolato "Thomas Hariot e il circolo degli atomisti inglesi", un'immersione nella biografia e nei contributi del suddetto matematico e astronomo, con particolare riferimento alla teoria atomica.Quello che leggerete è un meraviglioso viaggio tra storia, matematica, fisica, chimica, astronomia e persino letteratura, come si confà al blog Popinga, il cui sottotitolo altro non è che "Scienza e Letteratura".
Ne riporto un breve frammento:
"L'atomismo matematico di Hariot rifletteva la sua teoria della materia. Come Democrito ed Erone di Alessandria, egli era convinto che l’universo sia composto da atomi immersi nel vuoto. Gli atomi sono eterni, pieni, omogenei. Le qualità fisiche dei corpi sono il risultato della grandezza, forma, e movimento degli atomi costituenti o dei corpuscoli formati da essi. Nel sistema di Hariot il ruolo del movimento è fondamentale: “Nulla si fa senza il moto, e non c’è moto senza causa. Dal nulla non proviene nulla”.
Hariot pensava che i corpi omogenei possiedano atomi della stessa forma con densità uniforme. I corpi più densi consistono di atomi che si toccano da tutti i lati, mentre quelli più leggeri hanno dello spazio vuoto tra di loro. Le alterazioni chimiche che danno luogo a cambiamenti di peso sono causate dall’interposizione di atomi più piccoli nei vuoti tra quelli più grandi. I corpi duri e quelli morbidi variano soprattutto per la grandezza e forma delle particelle che li compongono."
Insomma, un contributo da non perdere!
 Ed ora è il turno di Sergio Barocci, chimico autore di 149 lavori scientifici di cui 65 su riviste internazionali (per la sua presentazione completa guardate qui), con un corposo contributo proveniente da Chimicare (associazione culturale fondatrice del Carnevale della Chimica) e, nello specifico, dal blog chimiCOMPRENDE della suddetta associazione.
Ed ora è il turno di Sergio Barocci, chimico autore di 149 lavori scientifici di cui 65 su riviste internazionali (per la sua presentazione completa guardate qui), con un corposo contributo proveniente da Chimicare (associazione culturale fondatrice del Carnevale della Chimica) e, nello specifico, dal blog chimiCOMPRENDE della suddetta associazione.L'articolo in questione si intitola "Verso la nascita della chimica moderna: dalla teoria atomica di Dalton al sistema periodico degli elementi".
Trattasi di uno straordinario viaggio all'interno della storia della Chimica e della teoria atomica in particolare, un viaggio che vede come punto di partenza le originali idee del chimico John Dalton, il quale, riportando un breve frammento del post:
"enunciò i punti fondamentali della sua ipotesi nel 1803 in una memoriale lettera alla Società letteraria e filosofica di Manchester. Nel 1808 ripropose le sue idee in maniera più organica con il suo libro intitolato “A new system of chemical philosophy."
Vengono dunque descritti in maniera esemplare i fondamenti della teoria atomica di Dalton, che ebbe il gran merito di aver attribuito "un peso anche se piccolissimo all’ultima particella della materia e di assegnare al peso il ruolo di distinguere fra loro gli atomi dei diversi elementi".
Ed è proprio sul concetto di peso atomico che si concentra la parte centrale del lungo contributo, oltre che sulla nomenclatura introdotta da Berzelius nel 1815 e sulla teoria atomico-molecolare di Avogadro (non ben vista da Dalton e Berzelius).
La parte conclusiva del post va a descrivere principalmente cosa accadde nell'importante 1ª Conferenza Internazionale di Chimica, tenutasi nel 1860 a Karlsruhe, e come Mendeleev introdusse la sua famosa tavola periodica.
Riporto un altro piccolo stralcio dal contributo:
 "Dmitrij Ivanovič Mendeleev
nacque a Tobolsk in Siberia nel 1834. Ultimo di quattordici figli, fu
incoraggiato dalla madre a continuare gli studi nonostante che la morte
del padre li avesse lasciati in notevoli ristrettezze economiche. Con la
madre affrontò il viaggio per iscriversi all’Università di Mosca e qui
respinto, proseguì per Pietroburgo dove finalmente fub accettato come
studente. La figura della madre illuminò costantemente la sua vita
dedicata tutta allo studio e alla ricerca. Poco dopo la laurea
sospirata , riuscì a superare una grave crisi che si manifestò nel suo
fisico , minato dalla tubercolosi e provato dagli intensi studi e dai
tanti sacrifici. Come professore di Chimica della stessa Università di
Pietroburgo partecipò attivamente alla Conferenza di Karlsruhe nel 1860,
manifestando vivo interesse per le nuove idee propugnate da Cannizzaro e
per il suo particolare metodo di determinare la massa atomica degli
elementi. Ritornato a Pietroburgo, lavorò intensamente alla schedatura
dei 63 elementi allora noti e nel 1869 pubblicò la sua prima tavola del
sistema periodico con l’enunciato della legge della periodicità : “ le
proprietà degli elementi variano con cadenza periodica al crescere della
massa atomica."
"Dmitrij Ivanovič Mendeleev
nacque a Tobolsk in Siberia nel 1834. Ultimo di quattordici figli, fu
incoraggiato dalla madre a continuare gli studi nonostante che la morte
del padre li avesse lasciati in notevoli ristrettezze economiche. Con la
madre affrontò il viaggio per iscriversi all’Università di Mosca e qui
respinto, proseguì per Pietroburgo dove finalmente fub accettato come
studente. La figura della madre illuminò costantemente la sua vita
dedicata tutta allo studio e alla ricerca. Poco dopo la laurea
sospirata , riuscì a superare una grave crisi che si manifestò nel suo
fisico , minato dalla tubercolosi e provato dagli intensi studi e dai
tanti sacrifici. Come professore di Chimica della stessa Università di
Pietroburgo partecipò attivamente alla Conferenza di Karlsruhe nel 1860,
manifestando vivo interesse per le nuove idee propugnate da Cannizzaro e
per il suo particolare metodo di determinare la massa atomica degli
elementi. Ritornato a Pietroburgo, lavorò intensamente alla schedatura
dei 63 elementi allora noti e nel 1869 pubblicò la sua prima tavola del
sistema periodico con l’enunciato della legge della periodicità : “ le
proprietà degli elementi variano con cadenza periodica al crescere della
massa atomica." Il resto della meravigliosa narrazione vi aspetta su Chimicare.
 Gianluigi Filippelli, eclettico blogger scientifico appassionato di fumetti e habitué dei Carnevali, ci fa pervenire, dal suo blog Dropsea, un contributo dal titolo "Amico atomo", una lucida analisi che fa capire quanto lo sviluppo dell'energia atomica abbia rappresentato, almeno per buona parte del XX secolo, una via da perseguire al fine di ottenere grandi prospettive per il futuro.
Gianluigi Filippelli, eclettico blogger scientifico appassionato di fumetti e habitué dei Carnevali, ci fa pervenire, dal suo blog Dropsea, un contributo dal titolo "Amico atomo", una lucida analisi che fa capire quanto lo sviluppo dell'energia atomica abbia rappresentato, almeno per buona parte del XX secolo, una via da perseguire al fine di ottenere grandi prospettive per il futuro.Tuttavia, come scrive Gianluigi nel suo post:
"Sono stati gli incidenti nucleari a far fallire il sogno di una nuova era, o semplicemente l'impossibilità di vedere realizzare le città futuristiche che venivano rappresentate nelle riviste di scienza o nei pulp di genere fantascientifico, che contenevano sovente articoli divulgativi."
Il contributo presenta poi una vera e propria chicca, un superlativo documentario animato, targato Disney, incentrato nientemeno che sull'atomo e narrato dall'autorevole voce del fisico nucleare tedesco Heinz Haber.
Tutto questo potrete ammirarlo solamente recandovi sul blog di Gianluigi. Non ve ne pentirete!
Non poteva far mancare la sua presenza la "regina dei Carnevali", la straordinaria prof. Annarita Ruberto, che dal suo blog dedicato alle scienze, ovvero Scientificando, ci fa pervenire ben 3 contributi di elevatissima qualità.
 1) Abbiamo parlato nell'introduzione al Carnevale della celebre regola dell'ottetto. C'è però da dire che non tutte le sostanze rispondono a tale regola e una di queste sostanze è l'esafluoruro di zolfo, protagonista del primo contributo di Annarita. Infatti l'esafluoruro di zolfo è "una molecola ipervalente, ovvero una molecola in cui uno degli atomi, che la compongono, presenta, nel suo guscio elettronico più esterno, un numero di elettroni superiore ad otto". Il suddetto composto, inoltre, ha a che fare con un particolarissimo fenomeno noto come "effetto acqua invisibile". Di tutto questo ci parla la vulcanica prof. nel post intitolato, non a caso, "Esafluoruro di zolfo ed effetto acqua invisibile". Non lasciatevelo scappare! Non potrete resistere alla tentazione di scoprire che cos'è questo bizzarro effetto!
1) Abbiamo parlato nell'introduzione al Carnevale della celebre regola dell'ottetto. C'è però da dire che non tutte le sostanze rispondono a tale regola e una di queste sostanze è l'esafluoruro di zolfo, protagonista del primo contributo di Annarita. Infatti l'esafluoruro di zolfo è "una molecola ipervalente, ovvero una molecola in cui uno degli atomi, che la compongono, presenta, nel suo guscio elettronico più esterno, un numero di elettroni superiore ad otto". Il suddetto composto, inoltre, ha a che fare con un particolarissimo fenomeno noto come "effetto acqua invisibile". Di tutto questo ci parla la vulcanica prof. nel post intitolato, non a caso, "Esafluoruro di zolfo ed effetto acqua invisibile". Non lasciatevelo scappare! Non potrete resistere alla tentazione di scoprire che cos'è questo bizzarro effetto! 2) Non sono terminati i trucchi "magici" (o meglio, chimici) che la brillante prof. propone per il nostro Carnevale. Il secondo contributo si intitola nientemeno che "Latte e magia di colori: un esperimento per grandi e piccini" e può essere visto come diviso in 2 parti: l'inizio del post descrive infatti le varie fasi da seguire per effettuare l'esperimento, dopodiché vi è la spiegazione dei meccanismi chimici che hanno portato all'incredibile risultato. Sì, ma che esperimento e che risultato? Con il latte? Ebbene, l'esperimento, in parole povere, consiste nell'introdurre del detersivo nel latte, il che produce un fenomeno meraviglioso poiché, come spiega magnificamente Annarita:
2) Non sono terminati i trucchi "magici" (o meglio, chimici) che la brillante prof. propone per il nostro Carnevale. Il secondo contributo si intitola nientemeno che "Latte e magia di colori: un esperimento per grandi e piccini" e può essere visto come diviso in 2 parti: l'inizio del post descrive infatti le varie fasi da seguire per effettuare l'esperimento, dopodiché vi è la spiegazione dei meccanismi chimici che hanno portato all'incredibile risultato. Sì, ma che esperimento e che risultato? Con il latte? Ebbene, l'esperimento, in parole povere, consiste nell'introdurre del detersivo nel latte, il che produce un fenomeno meraviglioso poiché, come spiega magnificamente Annarita:"Il detersivo reagisce con le proteine del latte, modificando la forma di tali molecole e mettendole in moto. La reazione tra il detersivo e il grasso forma le micelle."
Una micella, riportando la definizione fornita da Wikipedia, è un aggregato colloidale di molecole (colloide di associazione) formato da un tensioattivo in soluzione e che esiste in equilibrio con le molecole o ioni che concorrono a formare la micella stessa. Ed è proprio la formazione delle micelle a scatenare l'effetto "magico", che osserverete solamente recandovi su Scientificando!
 3) Dopo averci deliziato con alcune delle tante "magie" che la Chimica può eseguire, Annarita propone un post che porterà il lettore in mezzo alle meraviglie del cosmo: "Scoperte per la prima volta molecole di argon nella Nebulosa del Granchio". Ebbene, il post ci illustra in maniera chiara e precisa una recente affascinante scoperta in campo astronomico e intimamente legata alla Chimica. Infatti, come racconta Annarita in un fondamentale passaggio del suo articolo:
3) Dopo averci deliziato con alcune delle tante "magie" che la Chimica può eseguire, Annarita propone un post che porterà il lettore in mezzo alle meraviglie del cosmo: "Scoperte per la prima volta molecole di argon nella Nebulosa del Granchio". Ebbene, il post ci illustra in maniera chiara e precisa una recente affascinante scoperta in campo astronomico e intimamente legata alla Chimica. Infatti, come racconta Annarita in un fondamentale passaggio del suo articolo:"Un team di astronomi, studiando la Nebulosa del Granchio con Herschel [missione dell'Agenzia Spaziale Europea], ha individuato in questo resto di supernova una quantità di polvere maggiore del previsto (circa un quarto della massa del Sole). Le nuove osservazioni hanno evidenziato la presenza di molecole a base di Argon: per la prima volta è stata trovata nello spazio una molecola che è un composto di un gas nobile...Il team di astronomi ha [infatti] rilevato emissioni di idruro di Argon (ArH+), uno ione molecolare contenente l'argon."
Tale incredibile scoperta fornisce il "la" ad Annarita per parlare approfonditamente dell'argon (elemento n.18 della tavola periodica) e di questo particolare ione noto come idruro di Argon, il quale "viene prodotto quando gli ioni di argon (Ar+) reagiscono con molecole di idrogeno (H₂), ma queste due specie si trovano di solito in zone differenti di una nebulosa".
Se volete sapere come si è arrivati a capire e giustificare fino in fondo una scoperta che di primo acchito "sembrava bizzarra", non vi resta che leggere l'interessante post su Scientificando.
Continua la serie di contributi incentrati su specifici elementi della tavola periodica. All'appello ora risponde un'altra eminente presenza femminile dei Carnevali, la prof. Margherita Spanedda (che ha ospitato la fantastica edizione n.33 del Carnevale della Chimica, con tema "La Chimica e le Muse"), dall'alto del suo blog unpodichimica. Margherita ci parlerà di banane! No, scherzo, di potassio! Il suo contributo, denominato "Il potassio", si prefigge di cancellare dalla mente la banale associazione potassio-banana. Infatti, come ben ci fa capire Margherita nel suo meraviglioso post, il potassio è molto più di qualcosa che contengono i suddetti frutti.
Attraverso un'incantevole narrazione, Margherita ci descrive davvero a 360° il potassio, parlando della sua nascita, della sua scoperta, delle sue proprietà, dei suoi ioni e composti, e di molto altro, il tutto accompagnato da bellissimi riferimenti letterari di prosa e poesia.
Ecco un breve "antipasto" di ciò che vi aspetta su unpodichimica:
"Il potassio occupa la casella n°19 della tavola periodica, il che significa che ha 19 protoni nel suo nucleo e 19 elettroni nei suoi orbitali. La configurazione elettronica, ovvero il modo in cui i suoi elettroni si dispongono sugli orbitali, si può scrivere cosi
[Ar]s1
dove: Ar è il simbolo del gas nobile Argon, s è l’obitale 1 è il numero di elettroni presenti su quell’orbitale. E così, a colpo d’occhio, si vede quanto poco gli ci voglia per essere almeno un po’ simile all’argon e avere solo orbitali completi. Gli basterebbe eliminare quell’ unico elettrone e… Ecco quindi che l’irrequietezza del potassio, la sua formidabile reattività (e quella degli altri elementi del suo gruppo) può essere spiegata con la tendenza a disfarsi dell’ ingombrante elettrone."
Forza, non fate attendere troppo il potassio, altrimenti potrebbe decidere di esplodere per ripicca! ;)
E a proposito di banane:
 La sfilata degli elementi non finisce qui.
La sfilata degli elementi non finisce qui.Dall'argon e dal potassio passiamo ad un altro elemento chimico molto particolare: il tecnezio.
Di esso ci parla Palmiro P. Zavorka, assiduo partecipante dei Carnevali della Chimica e curatore del bel blog Knedliky, nel post intitolato appunto "Tecnezio".
Trattasi di un'interessante rassegna delle fondamentali proprietà del suddetto elemento, con una particolare attenzione all'analisi di suoi svariati isotopi e alle loro applicazioni in campo medico.
La parte finale dell'articolo è inoltre incentrata sul futuro della produzione dell'isotopo 99mTc.
Riporto l'incipit del contributo:
"Il Tecnezio è l'elemento chimico 43. Il suo simbolo è Tc. È un elemento presente in vari isotopi, tutti radiattivi, appartiene ai metalli di transizione, come materiale si presenta grigio argenteo, cristallino, molto raro in natura; il tecnezio è uno dei prodotti della fissione nucleare naturale ed artificiale dell'uranio e si usa in medicina nucleare per fare scintigrafie e tomografie degli organi interni (99mTc) oppure sulle superfici in acciaio protegge contro la corrosione in forma di ammonio pertectato (99gTc)."
Beh, che state aspettando? Andate a leggere il resto sul blog Knedliky.
 Ora è il turno di una new entry, almeno per quanto riguarda il Carnevale della Chimica. Sto alludendo a Marta Saponaro, curatrice del blog LETTORENONPERCASO, blog dalle mille sfaccettature, visto che spazia senza problemi dalla letteratura alla storia, dalla scienza alla matematica, dalla musica alla geografia e molto altro ancora. Per l'edizione n.34 del Carnevale della Chimica Marta ci propone il post intitolato "Atomi dell'Universo e atomi del corpo umano". Dopo una bella introduzione inerente agli atomi, i cui modi di combinarsi possono rispondere a domande come "che differenza c'è tra l'uomo e la sedia che spesso usa?", il post ci propone una perla da leggere tutta d'un fiato: l'intervista di Gianni Roghi al premio Nobel per la Chimica nel 1962 (per la scoperta della struttura molecolare dell'emoglobina) Max Perutz.
Ora è il turno di una new entry, almeno per quanto riguarda il Carnevale della Chimica. Sto alludendo a Marta Saponaro, curatrice del blog LETTORENONPERCASO, blog dalle mille sfaccettature, visto che spazia senza problemi dalla letteratura alla storia, dalla scienza alla matematica, dalla musica alla geografia e molto altro ancora. Per l'edizione n.34 del Carnevale della Chimica Marta ci propone il post intitolato "Atomi dell'Universo e atomi del corpo umano". Dopo una bella introduzione inerente agli atomi, i cui modi di combinarsi possono rispondere a domande come "che differenza c'è tra l'uomo e la sedia che spesso usa?", il post ci propone una perla da leggere tutta d'un fiato: l'intervista di Gianni Roghi al premio Nobel per la Chimica nel 1962 (per la scoperta della struttura molecolare dell'emoglobina) Max Perutz.Ne propongo qui solo l'incipit:
"Una volta, professor Perutz, gli uomini dicevano: il sasso, il minerale, l'acqua non vivono perché gli manca lo spirito vitale, la forza, il calore vitale. Non sapevano bene che cosa fosse, in realtà, questo spirito o questo calore che animava l'erba, l'insetto e l'uomo, ma sembrava loro di vederlo operante. E così immaginarono una quantità di teorie, in duemila anni di filosofia fino all'Illuminismo e più su ancora, per qualificare questa misteriosa forza che distingue la materia vivente dalla materia inerte: ma più che parole non furono. Bene: oggi che la scienza è andata avanti, che avanza sempre più in fretta, in progressione geometrica, possiamo forse cominciare a dare una risposta, una risposta di fondo, scientifica, a questa domanda fondamentale?
Sì, certo. Molte cose ci sono ancora oscure, ma non quelle, come dice lei, di fondo. La differenza tra il mondo inerte e il mondo vivente, tutto sommato, è l'ordine della complessità. Il mondo inerte è abbastanza semplice, mentre quello vivente è molto complicato. Una molecola inorganica contiene qualche decina di atomi, disposti in un certo ordine, ma una molecola vivente contiene centomila, un milione di atomi, anch'essi disposti in un ordine definito. La caratteristica principale delle molecole viventi è proprio questa diversa combinazione di ordine e di complessità."
Continua su LETTORENONPERCASO.
 Il prossimo contributo è stato scritto nientepopodimeno che da Franco Rosso, Presidente dell'Associazione Culturale Chimicare e ideatore del Carnevale della Chimica. Il post, denominato "Che cos'è un plasma?", proviene nello specifico dal blog chimiSPIEGA dell'associazione Chimicare e fornisce una spiegazione rigorosa, ma assai chiara relativa al cosiddetto "quarto stato della materia".
Il prossimo contributo è stato scritto nientepopodimeno che da Franco Rosso, Presidente dell'Associazione Culturale Chimicare e ideatore del Carnevale della Chimica. Il post, denominato "Che cos'è un plasma?", proviene nello specifico dal blog chimiSPIEGA dell'associazione Chimicare e fornisce una spiegazione rigorosa, ma assai chiara relativa al cosiddetto "quarto stato della materia".Il lettore verrà condotto in un incantevole itinerario tra le proprietà, le applicazioni e la creazione del plasma.
Ecco come inizia l'interessante post:
"Il plasma, in fisica, rappresenta uno stato di organizzazione della materia corrispondente a quello di un gas ionizzato. Tutti o più frequentemente una parte significativa degli atomi che compongono un plasma presentano una carica elettrica individuale positiva oppure negativa – imputabile rispettivamente alla cessione o all’acquisizione di elettroni – anche se nel suo insieme il corpo del plasma risulta elettricamente neutro in quanto queste cariche si compensano dal punto di vista statistico.
Procedendo quindi dallo stato solido a quello liquido, fino allo stato gassoso, lo stato di plasma costituisce un’ulteriore progressione nello stato energetico interno alla materia. Se nello stato gassoso le interazioni fra le singole particelle (per semplicità pensiamo ad un gas monoatomico, come ad esempio un gas nobile come l’elio o l’argon) potevano essere riportate in prima approssimazione all’effetto degli urti reciproci ed assolutamente casuali tra i singoli atomi, nel caso di uno stato di plasma le interazioni fra le particelle sono a più lungo raggio e precedono di gran lunga un eventuale contatto o “urto” fra di esse. In un plasma ogni particella elettricamente carica è condizionata nei suoi movimenti da altre particelle di carica uguale e di carica opposta, certamente di più da quelle vicine, ma in linea di principio da tutte quelle che compongono la massa. Il plasma si comporta quindi come un fluido unitario, nel suo insieme elettricamente neutro."
Le meraviglie dei plasmi vi stanno attendendo su Chimicare.
Anche il sottoscritto, Leonardo Petrillo, non fa mancare il suo contributo per il Carnevale. Ho infatti scritto, qui su Scienza e Musica, un post dal titolo "L'atomismo nel XVI e XVII secolo: i minima naturalia".
Trattasi di un articolo di carattere principalmente storico-filosofico, che va ad illustrare una visione antica e davvero poco nota dell'atomismo: quella dei cosiddetti minima naturalia.
In particolare, nel XVI secolo, come ho descritto in un passo del post:
"si verificò una "battaglia filosofica", che persistette per ben 2 secoli, tra 2 differenti visioni dell'atomismo:
1) una di tipo meccanico (di cui fu promotore nientemeno che Cartesio), ereditata dall'antica filosofia degli empiristi greci;
2) l'altra ispirata alla concezione aristotelica della continuità della materia.
La vera vincitrice di tale confronto intellettuale sarebbe stata la teoria atomica alla base della chimica moderna."
Nel contributo vengono passate in rassegna le idee filosofiche, con particolare riferimento alle teorie sui minima naturalia, di eminenti intellettuali del passato, da Aristotele ad Averroè, da Agostino Nifo a Scaligero, da Giordano Bruno a Daniel Sennert, da Angelo Sala fino a Pierre Gassendi, per il quale "Il vuoto e gli atomi rappresentavano i "principi primi" della struttura del mondo".
Il post si conclude con un simpatico video illustrante la storia degli atomi.
Ed ora, come promesso, la prima pausa musicale:
EXTRA MOENIA:
Non si potrebbe avere un vero Carnevale scientifico se non ci fosse una sezione di contributi che risultano fuori tema, i cosiddetti post "extra moenia".
I post che ammirerete in tale sezione, a dir la verità, non sono totalmente fuori tema (d'altronde, con un tema come "Atomi, ioni e particelle", tutto ciò che ha a che fare con la Chimica è coerente col tema proposto), ma non lo centrano in maniera netta, pertanto ho deciso di inserirli in questa altrettanto importante sezione.
 Il primo partecipante nella sezione "extra moenia" è la grande penna Spartaco Mencaroni, che gestisce il blog di scrittura creativa noto come Il Coniglio Mannaro. Spartaco (assieme al suo coniglio, lo cito altrimenti potrebbe offendersi il simpatico leporide!) è solito produrre meravigliosi racconti sui temi più disparati. Questa volta l'argomento della sua ispirazione è, ovviamente, la Chimica e, nello specifico, la Chimica in cucina. D'altronde il post che Spartaco ci fa pervenire si intitola "Di nonne, cipolle ed aldeidi leggere". Vi concedo solo un minuscolo "assaggio" del racconto:
Il primo partecipante nella sezione "extra moenia" è la grande penna Spartaco Mencaroni, che gestisce il blog di scrittura creativa noto come Il Coniglio Mannaro. Spartaco (assieme al suo coniglio, lo cito altrimenti potrebbe offendersi il simpatico leporide!) è solito produrre meravigliosi racconti sui temi più disparati. Questa volta l'argomento della sua ispirazione è, ovviamente, la Chimica e, nello specifico, la Chimica in cucina. D'altronde il post che Spartaco ci fa pervenire si intitola "Di nonne, cipolle ed aldeidi leggere". Vi concedo solo un minuscolo "assaggio" del racconto:"La piccola cucina è inondata di sole.
E’ la luce dorata, discreta e soffusa, di una giornata gelida
d’inverno, in cui anche il sole si copre di soffici nuvole, come se persino lui
soffrisse il freddo.
Arriccio il naso, lo sguardo va ai fornelli dove borbotta un plotone di pignatte e tegami; quelli
grossi, da guerra, che raramente vedono il mondo fuori dal proprio ripostiglio.
Annuso gli effluvi che salgono lenti dalle mutevoli superfici
di cottura, dove interfacce di composite miscele organiche gorgogliano,
ribollono, gemmano in vescicole viscose, da cui traboccano con liquidi schiamazzi le vaporose risultanze
delle energie convettive sottostanti."Vi consiglio vivamente di terminare la lettura, innanzitutto per la sua notevole qualità, in secondo luogo perché non è saggio far innervosire un coniglio mannaro!
 L'associazione Chimicare non fa mancare il suo supporto nemmeno in questa sezione. Quello che leggerete ora è un contributo (dal blog chimiSPIEGA) non a tema, ma allo stesso tempo a tema! No, tranquilli, nessun gatto di Schrödinger! Lo lasciamo un po' in pace questo povero gattino, almeno a Natale! Dove eravamo rimasti? Ma certo, stavamo dicendo che il contributo proveniente dai produttivi lidi di Chimicare, e scritto da Felicita Quagliozzi, non è a tema, tuttavia, allo stesso tempo, lo è. Come è possibile? Beh, il post in questione, intitolato "Non è tutta neve quella che luccica" non è propriamente focalizzato su "atomi, ioni e particelle", però è a tema col periodo natalizio! L'obiettivo del post è spiegare perché i fiocchi (o meglio, cristalli) di neve, in natura, presentino sempre 6 punte. Ed ecco un significativo frammento dell'articolo di Felicita:
L'associazione Chimicare non fa mancare il suo supporto nemmeno in questa sezione. Quello che leggerete ora è un contributo (dal blog chimiSPIEGA) non a tema, ma allo stesso tempo a tema! No, tranquilli, nessun gatto di Schrödinger! Lo lasciamo un po' in pace questo povero gattino, almeno a Natale! Dove eravamo rimasti? Ma certo, stavamo dicendo che il contributo proveniente dai produttivi lidi di Chimicare, e scritto da Felicita Quagliozzi, non è a tema, tuttavia, allo stesso tempo, lo è. Come è possibile? Beh, il post in questione, intitolato "Non è tutta neve quella che luccica" non è propriamente focalizzato su "atomi, ioni e particelle", però è a tema col periodo natalizio! L'obiettivo del post è spiegare perché i fiocchi (o meglio, cristalli) di neve, in natura, presentino sempre 6 punte. Ed ecco un significativo frammento dell'articolo di Felicita:"Immaginate di fare quattro passi in un etereo mare magnum di goccioline d’acqua in sospensione, miste a pulviscolo, particelle di ghiaccio amorfo e molecole di vapore, che fluttuano e si scontrano in un ampio volume d’aria più o meno fredda e turbolenta.
Quando la temperatura è sufficientemente bassa, un granello di polvere fa da nucleo di condensazione attorno al quale una gocciolina di vapore congela e si solidifica . Poi, a mano a mano che la temperatura scende ancora, il movimento delle molecole rallenta finché ciascuna si trova bloccata al vertice di un tetraedro, connessa ad altre quattro mediante legami covalenti e idrogeno. Gli angoli di questi tetraedri sono tali da organizzare più molecole secondo un reticolo esagonale e tridimensionale, a diversi strati."
Se siete curiosi di scoprire il resto della spiegazione, dirigetevi immediatamente su Chimicare.
A proposito di cristalli, sapevate che il 2014 sarà l'Anno Internazionale della Cristallografia?
L'ultimo partecipante a questo evento è Paolo Pascucci, anch'egli poliedrico blogger e assiduo contributore nei carnevali scientifici. Dal suo blog Questione della Decisione ci fa arrivare un contributo molto particolare, denominato "Giochi chimici: trova il colpevole con la PCR". Paolo ci illustra un simpatico e istruttivo gioco, proposto dalla fondazione Nobel Prize, concernente la PCR, ovvero la reazione a catena della polimerasi. La trama alla base del gioco è la seguente: viene rubato un gioiello prezioso e noi abbiamo il compito di scoprire a quale dei 2 sospettati appartiene il materiale genetico rinvenuto sul luogo del delitto. Tuttavia, prima di poter testare le nostre abilità di videogiocatori, ci viene mostrata un'interessante lezione animata sulla PCR. Insomma, un contributo che mette insieme divertimento e istruzione, un binomio che troppo spesso non va insieme!
È giunto il momento della seconda (e ultima) ondata di musica natalizia:
Il Carnevale è arrivato ormai alle fasi conclusive.
È stato un vero piacere organizzare, per la seconda volta, un Carnevale della Chimica.
Spero che la lettura, la visione e l'ascolto di questa imponente mole di roba sia stata piacevole e divertente!
Il primo ringraziamento va come sempre ai bravissimi carnevalisti, che pure in questo periodo di feste non hanno fatto mancare i loro splendidi contributi.
Di seguito, per riassumere il quadro, un elenco sinottico dei partecipanti:
Marco Fulvio Barozzi
Sergio Barocci
Gianluigi Filippelli
Annarita Ruberto
Margherita Spanedda
Palmiro P. Zavorka
Marta Saponaro
Franco Rosso
Spartaco Mencaroni
Felicita Quagliozzi
Paolo Pascucci
Leonardo Petrillo
Un ultimo doveroso ringraziamento va ai lettori che si fermeranno a leggere il Carnevale, restando magari catturati da una curiosità o un particolare, inerente alla Chimica, in esso presente.
Il momento di calare il sipario è arrivato!
Auguro un sereno e felice Natale ai carnevalisti e a tutti i lettori di Scienza e Musica!
Il Carnevale volge alla fine con un classico natalizio Disney.























.gif)










Ciao, Leo. Ho appena dato una lettura veloce al post. Mi riprometto di approfondire con calma il tutto, questa sera.
RispondiEliminaCome al solito, la qualità della tua kermesse è alta.
Bravissimo! Congrats:)
Buon Carnevale e Buone Feste a tutti!
Grazie infinite anche qui, Annarita!
EliminaCome al solito un grandissimo carnevale di Leonardo. Le tue introduzioni ai carnevali sono, molto spesso, piccoli ripassi di storia della scienza, utili anche come preparazione scolastica. E poi si sente che ci metti sempre grande passione. Sei un esempio per tutti
RispondiEliminaIl tuo commento mi lusinga, caro Paolo! Grazie mille!
EliminaMa quanta bella roba! Mi ci vorrà un bel po' per leggere i vari contributi. Nel frattempo mi sono stragoduto la tua non-introduzione; come si fa a chiamare introduzione tutto quel popò di roba.
RispondiEliminaLeo non delude mai.
Approfitto per fare a te ed agli amici carnevalisti i miei migliori auguri per un felice Natale.
Ti ringrazio anche qui del bellissimo commento! :)
EliminaSono finalmente riuscita a leggere questa tua presentazione. Magnifica è dire poco mi sono permessa di scrivere un post sul tuo articolo a dir poco stupendo. Questo è il link, spero non ti dispiaccia, auguroni di Buon Natale
RispondiEliminahttp://lettorenonpercaso.blogspot.it/search/label/ATOMI%20IONI%20E%20PARTICELLE%20%28CARNEVALE%20DELLA%20CHIMICA%29
Felice che ti sia piaciuto, Marta! Grazie mille della segnalazione sul tuo blog, ne sono onorato!
EliminaMi aspettavo la citazione di "Ionisation" di E. Varese, visto il tema del carnevale... Bravo, Leonardo! Bella rassegna pre-natalizia, ben trovata sotto l'albero. Congratulazioni a tutti i partecipanti. MC
RispondiEliminaGrazie mille, Marco, per l'apprezzamento! Buon Natale!!!!
EliminaCon i preparativi di Natale in mezzo sono riuscito solo ora a rendermi conto di quanto ricca e riuscita (sia dal punto di vista tecnico che umano) sia stata anche questa edizione del Carnevale della Chimica, a dispetto di coloro che gufavano su un ineluttabile declino del format.
RispondiEliminaE comunque sì, confermo: Leonardo è una risorsa da tutelare per la blogsfera scientifica italiana :-)
Che dire? Sono davvero lusingato dal tuo commento, caro Franco!
EliminaBuon Carnevale della Chimica e felice Natale!!!!!
Leonardo, la tua introduzione valeva da sola anche in un Carnevale senza altri contributi. Sei bravissimo! Complimenti e auguri a te e a tutti i partecipanti.
RispondiEliminaLieto che ti sia piaciuta così tanto l'introduzione!
EliminaI partecipanti sono stati altrettanto bravissimi a produrre contributi di così alta qualità (e quasi tutti a tema) in questo periodo festivo.
Grazie del commento, della partecipazione e tanti tanti Auguri di Buon Natale!!!!
Caro Leonardo,
RispondiEliminaavevo sbirciato a suo tempo alcuni dei contributi, potassio in testa, ma ora ripassando trovo premonitrice la tua frase: Il Carnevale volge alla fine... è così fu! saluti
Purtroppo quella frase è stata (non volontariamente) sì premonitrice del futuro del Carnevale della Chimica. :(
Elimina